重组胶原蛋白行业的发展一直伴随着诸多争议。5月24日,知名美妆博主“大嘴博士”郝宇(以下简称”郝宇“)在其公众号发布了一篇题为《巨子生物疑似造假?!重组胶原竟然测不到胶原!》的文章,实名质疑自称为“全球重组胶原蛋白领导者”的巨子生物涉嫌严重产品质量问题,这起围绕“消失的重组胶原蛋白”舆论被推送至风口浪尖。
文章中,郝宇公开质疑可复美品牌旗下产品“可复美胶原棒”(即“可复美重组胶原蛋白肌御修护次抛精华”)不含胶原蛋白核心氨基酸成分“甘氨酸”,即重组胶原蛋白的实际添加量远未达到宣称标准。
不少业内人士联想到美国著名“坏血案”中的伊丽莎白·霍姆斯案例——其董事会成员包括前国务卿等知名人物,因最终因欺诈被判刑11年。
而据郝宇介绍,他最早是从 2022 年开始对广告中描述的“拒绝外资收购 ”的真实性、专利的价值, “重组 胶原蛋白全球领导者 ”地位是否属实展开了学术调查,并其曾于2024年就已公开发布相关调查及质疑文章。
其核心质疑有两点:
核心质疑之一:自封的“全球重组胶原蛋白领导者 ”,真的有领导者的技术吗?
据郝宇介绍,这家公司在市场营销中,反复强调自己是重组胶原蛋白领域的“全球领导者 ” 地位。然而,当深入研究其技术路线的根本,就会发现其核心技术方向存在一个根本性问题:其宣称的“重组胶原蛋白全球领导者 ”,并没有领导者的技术。
在生物化学领域,一个分子要被称为“蛋白质 ”,绝非仅仅是氨基酸的简单串联。它必须具备稳定的、折叠形成特定的结构。因为蛋白质结构,是蛋白质能发挥功能(无论是作为酶、受体还是结构支撑)的最重要的基础。例如,胶原蛋白的标志性特征正是其独特的三螺旋结构。如果仅仅是一段不具备稳定高级结构的氨基酸链,它在科学上只能被定义为多肽,功能也和真正的蛋白质有着 天壤之别。
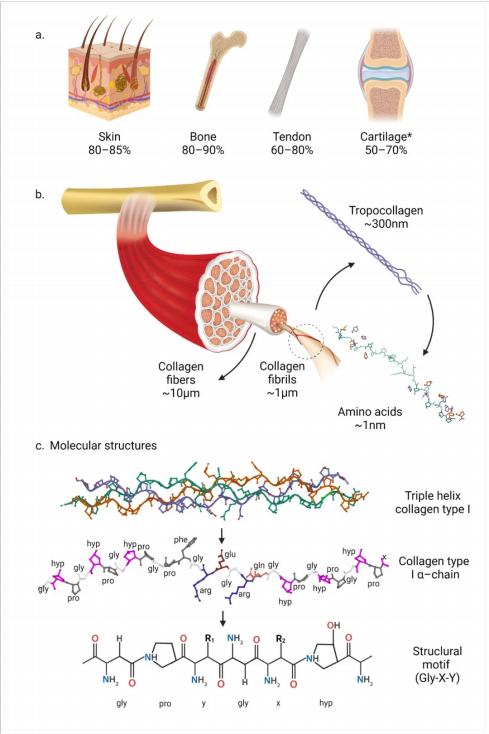
(a)I 型胶原蛋白的来源及各组织中的大致含量。 * 软骨的百分比基于所有胶原蛋白的干重, 因为软骨主要由 II 型胶原蛋白组成。(b )胶原蛋白纤维结构、原纤维、作为原胶原蛋白的 α 链三螺旋结构以及氨基酸残基。( c)三螺旋和单链 I 型胶原蛋白分子结构 (PDB 1CAG), 包含 甘氨酸-x-y 重复序列;x-y 通常分别代表脯氨酸和羟脯氨酸。
Amirrah I N, Lokanathan Y, Zulkiflee I, et al. A comprehensive review on collagen type I development of biomaterials for tissue engineering: From biosynthesis to
bioscaffold[J]. Biomedicines, 2022, 10(9): 2307.
在美国FDA 在审批生物制品(Biologics License Application, BLA)中,对重组蛋白药物有着极其严格的要求。要求申请者必须提供详尽数据,全面表征蛋白质的一级氨基酸序列、翻译后修饰、以及至关重要的二级、三级甚至四级高级结构。
然而,巨子生物的产品未能证明具有稳定的结构,导致其三类医疗器械证迟迟未获批准。截至2025年4月的数据显示,国内各企业在三类医疗器械证的获批情况差异显著。
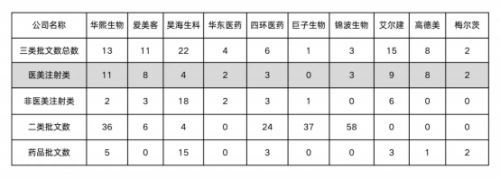
数据来源:国家药品 监督管理局
在技术专利方面,巨子生物宣称解决“高透皮吸收”难题的一项专利,实验方法采用了“冷冻后再解冻的鼠皮”。皮肤科学领域的研究(如《Agache’s Measuring the Skin 皮肤测量学》所述)表明,冷冻-解冻过程会破坏皮肤角质层,导致渗透性增加。这种模型得出的高渗透性结论,难以支撑颠覆性发明的宣称。事实上,全球多肽和蛋白质组学的前沿研究并未被巨子生物超越,相关专利仍属多肽范畴。
核心质疑之二: 行业标准问题也加剧了乱象,企业操纵“标准 ”欺骗消费者。
郝宇表示,其曾参与过2023年《重组胶原蛋白生物材料命名指导原则》起草工作,在与一位专家交流中提出疑问:为什么不顾科学共同体对蛋白质的定义,将本属于多肽的物质冠以“胶原蛋白 ”的名称?专家曾表示有争论,但有人呼吁要顾及到产业发展。
类似的声音,在2008年的三聚氰胺事件中也有出现,因部分“专家 ”明知凯氏定氮法会造成严重纰漏,要顾及产业现实和标准,导致30万孩子患病,从而使整个中国乳粉产业遭受了史无前例的信任危机。“无数产业历史上的沉痛教训告诉我们:起心动念不正的标准和命名规范无法造就,需要高标准历练的中国产业和中国品牌。”郝宇说。
据了解,市场中存在很多本质上为多肽的物质(如二肽)被冠以“胶原蛋白”名义。这种命名漏洞被部分企业利用,导致市场混乱:不同企业的产品在基因序列、生产工艺、结构活性和效果上差异巨大,却共享“重组胶原蛋白”名称。这种低标准环境助长了“劣币驱逐良币”现象,运营型企业通过营销和水军占据优势,而需严格监管的三类医疗器械却面临不公平竞争。长远看,这种标准无法与国际接轨,可能阻碍中国产业的全球竞争力。
医药行业给化妆品行业的启示:用高标准监管激发优质创新
中国医药行业的经验提供了借鉴。10 年前,中国医药行业也曾面临着低质的困境,产品创新少,国际竞争力弱。 然而,2015 年开始的政策改革开启了中国创新药元年,当年8 月,国务院发布 《国务院关于改革药品医疗器械审评审批制度的意见》,明确提出提高审评审 批质量,明确了责任落实,鼓励以临床价值为导向的药物创新。此后各类监管 政策纷纷出台,中国创新药迎来前所未有的大发展。
药企创新成果的涌现,背后既需要利好于产业创新的审批制度,更需要高标准 的严格监管。通过“仿制药一致性评价 ”、“药品上市许可持有人(MAH)制 度 ”、“带量采购 ”等一系列改革,彻底清除了“劣质药 ”生存土壤。虽然这 个过程充满阵痛,但促使了中国医药企业加大研发投入、苦练内功。
根据证券时报所披露的数据,中国 2024 年透明质酸的 出口量为 161 吨,而同期重组胶原蛋白的出口量仅为0.02 吨(多为多肽)。且全球无获批的三类医美器械,凸显该分支的实际挑战。重组胶原蛋白的未来,离不开高标准监管的保障。郝宇表示:“行业应避免沉溺于“科研爽剧”的虚假繁荣,防止劣质产品和营销挤压优质创新空间。美妆和医美行业正与生命科学前沿融合,监管缺失可能导致悲剧重演。”他再次呼吁完善制度设计,确保公平竞争和产业长远发展。
今天的美妆、医美行业远远不是一个面子上的行业,早已与生命科学的衰老干 预前沿高度融合,并在依靠着强大的盈利能力反哺着生命科学前沿研究的资金缺口,但也考验着制度设计的远见与监管的哲学。